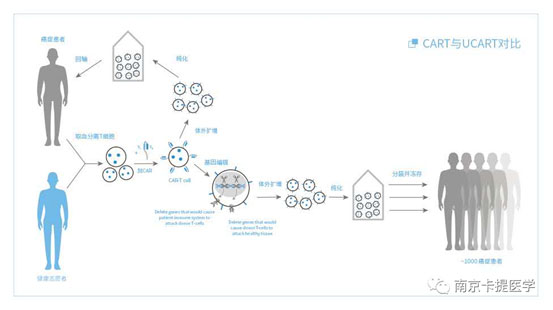
“现成的”同种异体CAR-T细胞的发展与挑战
南京卡提医学 7月10日
1.自体CAR-T细胞疗法与同种异体CAR-T细胞疗法
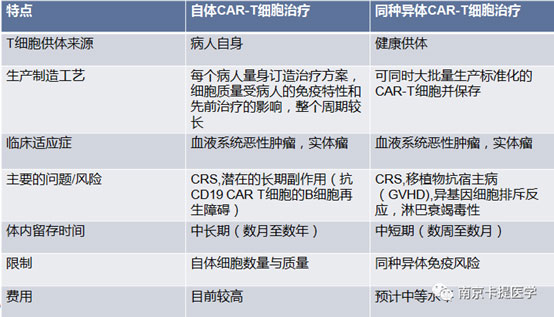
2.同种异体CAR-T细胞治疗的优点
来源:来自健康的捐赠者,这些细胞没有受到癌症免疫效应的影响,也没有受到化疗药物的影响,与患者的自体T细胞形成的不同。
周期:与自体CAR-T治疗相比,同种异体CAR-T可以缩短治疗的周期,可以利用已经批量制备好的细胞迅速进行治疗。
成本:通过标准化的制备大批量的CRA-T细胞,从而较大程度的降低了成本。
3.同种异体CAR-T治疗的主要问题及解决思路
Ø移植物抗宿主病(GVHD);
Ø异基因T细胞可能被宿主细胞识别并清除。
Ø使用来自干细胞移植供体的同种异体CART细胞;
Ø使用病毒特异性记忆T细胞;
Ø使用非αβT细胞;
Ø使用基因编辑方法。
4.使用来自干细胞移植供体的同种异体CAR T细胞
可从胚胎干细胞和诱导多能干细胞(IPSC)中产生T细胞。胎盘源性干细胞可用于产生T细胞或自然杀伤细胞,胎盘具有独特的人类白细胞抗原(HLA)表达模式。与其他组织有所不同,绒毛外细胞滋养层细胞只表达HLA-C、HLA-E和HLA-G,不过这些特异性对胎盘源性T细胞的影响还没有报道。IPSC也可以是CAR-T细胞的来源,一个具有共同HLA单倍型的iPSCs库可以用来降低CAR-iPSCT细胞异基因排斥的风险。iPSCs的一个优点是CAR T细胞由一个多能干细胞系产生,因此是同质的。
5.使用病毒特异性记忆T细胞
病毒特异性T细胞被用于治疗病毒感染。技术的进步使记忆性病毒特异性T细胞的纯化成为可能,这种T细胞可以预防没有GVHD临床症状的病毒性疾病。从健康献血者过继转移HLA部分匹配的病毒特异性T细胞对爱泼斯坦-巴尔病毒相关的恶性肿瘤(如移植后淋巴增殖性疾病)有积极的结果,有效率为60-70%,毒性或GVHD的发生率较低)。因此,一些组织和生物技术公司正在开发基于异基因爱泼斯坦-巴尔病毒特异性T细胞系的CART细胞系。
6.使用非αβT细胞
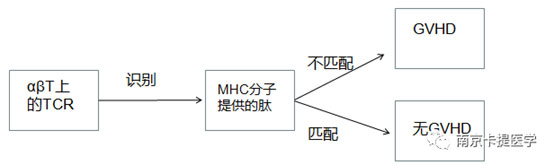
MHC分子:主要组织相容性复合体.
NK细胞最初被认为具有杀死肿瘤细胞的能力,是机体自然肿瘤免疫监视的一个组成部分,几项研究表明,不同类型癌症的NK细胞功能紊乱,说明癌症已经进化出逃避NK细胞杀伤的机制。因此,为NK细胞提供CAR来增强NK细胞的抗肿瘤活性是一个很有吸引力的策略。
7.使用基因编辑方法
由于αβT的TCR片段在植入物排斥反应中起决定性作用,所以研究人员开发出了阻止功能性TCR在αβT细胞表面表达的方法,在预先选择的位置产生特定的DNA双链断裂,同时尽可能避免目标外的断裂。一旦DNA断裂发生,细胞DNA修复机制将通过容易出错的非同源末端连接途径导致基因失活(基因敲除),或通过同源重组途径导致基因插入或纠正(基因敲除)。第一个报道的研究评估了在CART细胞中敲除TRAC的可行性报告作者指出,通过锌指技术消除TCR的表达并不会损害CD19特异性CART细胞的抗肿瘤特性。
8.同种异体CAR T细胞治疗面临的挑战

9.同种异体CAR-T在体内的增殖
经过长期研究已经确定淋巴消耗性化疗是有效的T细胞体内扩增所必需的。T细胞在转移到淋巴细胞减少的宿主后,会经历一个称为稳态膨胀的过程。这种扩张是由稳态细胞因子如IL-7和IL-15以及暴露于自身抗原和其他抗原所驱动的。最佳的预处理方案尚未确定,采用基因敲除方法的同种异体CAR-T细胞缺乏TCR表达可能是一个优势,因为TCR参与在结合CAR激活时会对CD8+CART细胞的扩张产生负面影响,但是以上结论是在小鼠模型中得出的,还需要更多临床数据的支持。
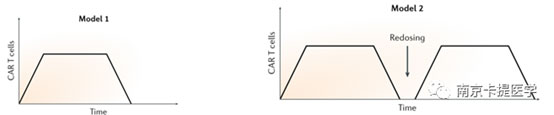
10.同种异体CAR T细胞的持久性
同种异体CAR-T细胞体内存活周期较短,但是根据疾病性质、肿瘤负荷和其他因素,CART细胞存活的最佳持续时间可能有所不同,可以考虑到两种情况。
大多数表达靶抗原的肿瘤细胞可被CART细胞利用。如果扩增后能获得足够的效应细胞与靶细胞的比例,那么在清除肿瘤细胞后,就不需要维持长期的持久性。2.在第二种情况下,可能更常见,对T细胞杀伤不太敏感的肿瘤细胞群持续到临床完全缓解,在这种情况下,有必要设想通过CARTT细胞长期控制残留疾病。可以设想在第一次给药后,再进行几次同种异体CAR-T的给药。这种做法局限性是每次给药前要进行淋巴清除,需要限制淋巴清除的力度和给药次数。
11.血液系统恶性肿瘤的临床观察
同种异体CART细胞提供了治疗复发性或难治性恶性肿瘤的可能性,对于进展迅速的疾病,如AML和ALL,这可能是一个主要优势。已经开始对ALL和AML进行试验,并计划在淋巴瘤和多发性骨髓瘤中进行试验。靶点与自体途径相似,包括ALL和B细胞淋巴瘤中的CD19和CD22,霍奇金淋巴瘤和间变性大细胞淋巴瘤中的CD30,多发性骨髓瘤中的B细胞成熟蛋白(BCMA,也称为TNFRSF17)、CS1(也称为SLAMF7)和CD38,以及CD123。对于CD123这样的正常细胞也表达的靶点,同种异体CART细胞的持续时间较短可能是一个优势。
12.在实体瘤中的表现
CART细胞在实体瘤中的表现远不如在血液恶性肿瘤中表现出令人满意的结果,诱导更强大的CAR-T细胞来应对实体瘤微环境和氧化应激是很好的研究方向。目前有以下几种策略来使CAR-T细胞抵抗肿瘤微环境。
使CAR-T细胞抵抗肿瘤微环境。表达过氧化氢酶的CAR T细胞在H2O2诱导的氧化应激下保持其抗肿瘤活性
使用多个步骤的基因编辑来优化CAR-T细胞功能。有人提出了一些降低T细胞对阴性免疫检查点和免疫抑制的敏感性的策略
结合来自肿瘤微环境的多种信号来激活肿瘤中的T细胞。利用三组分分裂CAR系统构建的T细胞,其内域通过传递信号1(通过CD3ζ激活)重现生理性T细胞信号,信号2(通过4-1BB的共刺激)和信号3(细胞因子释放(IL-7))。
13.结论
CAR-T细胞治疗是治疗癌症最有前途的方法之一,在此基础上开发通用型的CAR-T细胞,降低成本,使得更多的人有机会使用这种疗法。并且已经开发出新的技术使得宿主的免疫系统对同种异体AR-T细胞反应更低甚至“隐形”。尽管在提高CAR-T疗效方面还有很多挑战,特别是在实体瘤中,但是还有很多方法可以实现优化。